Glikolisis (dari glycose, istilah yang
lebih tua untuk glukosa +-lisis degradasi) adalah yang mengubah jalur
metabolisme glukosa, C6H12O6, menjadi piruvat, CH3COCOO-+ H +. Energi
bebas dilepaskan dalam proses ini digunakan untuk membentuk senyawa
energi tinggi, ATP (adenosin trifosfat) dan NADH (dikurangi nikotinamid
adenin dinukleotida).
Glikolisis adalah urutan tertentu yang melibatkan sepuluh sepuluh
reaksi antara senyawa (salah satu langkah yang melibatkan dua zat
antara). The intermediet memberikan entry point untuk glikolisis.
Sebagai contoh, sebagian besar monosakarida, seperti fruktosa, glukosa,
dan galaktosa, dapat dikonversi ke salah satu peralihan ini. The
intermediet mungkin juga akan langsung berguna. Sebagai contoh, antara
dihydroxyacetone fosfat adalah sumber yang mengkombinasikan gliserol
dengan asam lemak untuk membentuk lemak. (Pathmanaban)
Glikolisis adalah dianggap sebagai pola dasar yang universal jalur
metabolisme. Terjadi, dengan variasi, di hampir semua organisme, baik
aerobik dan anaerobik. Lebar terjadinya glikolisis mengindikasikan bahwa
ini merupakan salah satu yang dikenal paling kuno metabolisme.
Jenis yang paling umum glikolisis adalah Embden-Meyerhof-Parnus
jalur, yang pertama kali ditemukan oleh Gustav Embden dan Otto Meyerhof
dan Parnus. Glikolisis juga mengacu pada jalur-jalur lainnya, seperti
jalur Entner-Doudoroff. Namun, diskusi di sini akan dibatasi pada jalur
Embden-Meyerhof.
Gambaran
Keseluruhan reaksi glikolisis adalah:
| D-[Glucose] | [Pyruvate] | ||||
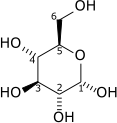 |
+ 2 [NAD]+ + 2 [ADP] + 2 [P]i |  |
2 | 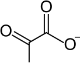 |
+ 2 [NADH] + 2 H+ + 2 [ATP] + 2 H2O |
Penggunaan simbol dalam persamaan ini
membuatnya tampak tidak seimbang berkenaan dengan atom oksigen, hidrogen
atom dan biaya. Atom keseimbangan dijaga oleh dua fosfat (Pi) kelompok
[3]:
- Masing-masing ada dalam bentuk fosfat hidrogen anion (HPO42-), disosiasi untuk berkontribusi 2 H + secara keseluruhan
- Masing-masing membebaskan atom oksigen ketika mengikat ke ADP (adenosin difosfat) molekul, menyumbang 2 O keseluruhan
Biaya diimbangi oleh perbedaan antara ADP dan ATP. Dalam lingkungan
selular ketiga kelompok hidroksi ADP terdisosiasi menjadi-O-dan H +,
memberikan ADP3-, dan ion ini cenderung berada dalam ikatan ionik dengan
Mg2 +, memberikan ADPMg-. ATP berperilaku secara identik kecuali bahwa
ia memiliki empat kelompok hidroksi, memberikan ATPMg2-. Ketika
perbedaan ini bersama dengan biaya sebenarnya pada dua gugus fosfat
dianggap bersama-sama, tuduhan bersih -4 di setiap sisi yang seimbang.
Untuk fermentations anaerobik sederhana, metabolisme dari satu
molekul glukosa menjadi dua molekul piruvat memiliki hasil bersih dua
molekul ATP. Sebagian besar sel kemudian akan melakukan reaksi lebih
lanjut untuk ‘membayar’ yang digunakan NAD + dan menghasilkan produk
akhir dari etanol atau asam laktat. Banyak bakteri menggunakan senyawa
anorganik sebagai akseptor hidrogen untuk meregenerasi NAD +.
Sel melakukan respirasi aerobik lebih mensintesis ATP, tetapi bukan
sebagai bagian dari glikolisis. Ini reaksi aerobik lebih lanjut
menggunakan piruvat dan NADH + H + dari glikolisis. Eukariotik respirasi
aerobik tambahan menghasilkan kira-kira 34 molekul ATP untuk setiap
molekul glukosa, namun sebagian besar diproduksi oleh mekanisme yang
sangat berbeda pada tingkat substrat fosforilasi dalam glikolisis.
Produksi energi yang lebih rendah, per glukosa, respirasi anaerob
relatif terhadap respirasi aerobik, menghasilkan fluks yang lebih besar
melalui jalur di bawah hipoksia (oksigen rendah) kondisi, kecuali
alternatif sumber-oxidizable anaerobik substrat, seperti asam lemak,
yang ditemukan.
Pada tahun 1860 Louis Pasteur menemukan bahwa mikroorganisme yang
bertanggung jawab untuk fermentasi. Pada tahun 1897 Eduard Buchner
menemukan bahwa ekstrak dari sel-sel tertentu dapat menyebabkan
fermentasi. Pada tahun 1905 Arthur Harden dan William Young bertekad
bahwa peka panas tinggi berat molekul-fraksi subselular (enzim) dan
tidak peka panas rendah sitoplasma berat molekul-fraksi (ADP, ATP dan
NAD + dan kofaktor lainnya) yang diperlukan bersama-sama untuk
fermentasi untuk melanjutkan. Rincian jalur akhirnya ditentukan oleh
1940, dengan masukan utama dari Otto Meyerhof dan beberapa tahun
kemudian oleh Luis Leloir. Kesulitan terbesar dalam menentukan
seluk-beluk jalur itu karena seumur hidup yang sangat pendek dan kondisi
mapan rendah konsentrasi pada peralihan dari glikolitik reaksi cepat.
Urutan Reaksi
Tahap persiapan
Lima langkah pertama dianggap sebagai persiapan (atau investasi) fase
sejak mereka mengkonsumsi energi untuk mengubah glukosa menjadi dua
tiga-karbon gula fosfat.
Langkah pertama dalam glikolisis adalah
fosforilasi glukosa oleh sebuah keluarga enzim yang disebut hexokinases
untuk membentuk glukosa 6-fosfat (G6P). Reaksi ini mengkonsumsi ATP,
tetapi ia bertindak untuk menjaga konsentrasi glukosa rendah,
terus-menerus mempromosikan transportasi glukosa ke dalam sel melalui
membran plasma transporter. Selain itu, blok glukosa dari bocor keluar –
kekurangan sel transporter untuk G6P. Glukosa mungkin alternatif dapat
dari phosphorolysis atau hidrolisis pati intraselular atau glikogen.
| D-Glucose (Glc) | Hexokinase (HK) a transferase |
α-D-Glucose-6-phosphate (G6P) | |
 |
 |
||
| ATP | H+ + ADP | ||
 |
|||
Pada hewan, sebuah isozyme dari heksokinase disebut glukokinase juga
digunakan dalam hati, yang memiliki afinitas yang jauh lebih rendah
untuk glukosa (Km di sekitar glycemia normal), dan berbeda dalam
peraturan properti. Afinitas substrat yang berbeda dan peraturan
alternatif enzim ini merupakan cerminan dari peran hati dalam menjaga
kadar gula darah.
Kofaktor: Mg2 +
G6P kemudian disusun kembali menjadi
fruktosa 6-fosfat (F6P) oleh glukosa fosfat isomerase. Fruktosa juga
dapat memasukkan jalur glikolitik oleh fosforilasi pada titik ini.
| α-D-Glucose 6-phosphate (G6P) | Phosphoglucose isomerase an isomerase |
β-D-Fructose 6-phosphate (F6P) | |
 |
 |
||
 |
|||
Perubahan dalam struktur adalah isomerization, di mana telah G6P
dikonversikan ke F6P. Membutuhkan reaksi enzim, phosphohexose isomerase,
untuk melanjutkan. Reaksi ini reversibel secara bebas di bawah kondisi
sel normal. Namun, sering didorong ke depan karena konsentrasi rendah
F6P, yang terus-menerus dikonsumsi selama langkah berikutnya glikolisis.
Kondisi F6P tinggi konsentrasi reaksi ini mudah berjalan terbalik.
Fenomena ini dapat dijelaskan melalui Prinsip Le Chatelier.
Pengeluaran energi ATP lain dalam langkah
ini adalah dibenarkan dalam 2 cara: The glikolitik proses (sampai
dengan langkah ini) sekarang ireversibel, dan energi disediakan
mendestabilkan molekul. Karena reaksi dikatalisis oleh fosfofruktokinase
1 (PFK-1) adalah penuh semangat sangat menguntungkan, pada dasarnya
tidak dapat diubah, dan jalur yang berbeda harus digunakan untuk
melakukan konversi selama glukoneogenesis sebaliknya. Hal ini membuat
reaksi titik regulasi kunci (lihat di bawah). Ini juga merupakan langkah
rate limiting.
| β-D-Fructose 6-phosphate (F6P) | phosphofructokinase (PFK-1) a transferase |
β-D-Fructose 1,6-bisphosphate (F1,6BP) | |
 |
 |
||
| ATP | H+ + ADP | ||
 |
|||
Reaksi yang sama juga dapat dikatalisis oleh pyrophosphate tergantung
fosfofruktokinase (PFP atau PPI-PFK), yang ditemukan di sebagian besar
tumbuhan, beberapa bakteri, archea dan protista tetapi tidak pada hewan.
Enzim ini menggunakan pyrophosphate (PPI) sebagai donor fosfat, bukan
ATP. Ini merupakan reaksi reversibel, meningkatkan fleksibilitas
glikolitik metabolisme. Sebuah jarang ADP-PFK tergantung varian enzim
telah diidentifikasi dalam archaean spesies.
Kofaktor: Mg2 +
Mendestabilisasi molekul dalam reaksi
sebelumnya memungkinkan cincin heksosa untuk dibagi oleh aldolase
menjadi dua triose gula, dihydroxyacetone fosfat, keton, dan
gliseraldehida 3-fosfat, aldehida. Ada dua kelas aldolases: kelas I
aldolases, hadir pada hewan dan tumbuhan, dan kelas II yang hadir dalam
aldolases jamur dan bakteri; kedua kelas menggunakan berbagai mekanisme
yang ketosa berlayar padanya cincin.
| β-D-Fructose 1,6-bisphosphate (F1,6BP) | fructose bisphosphate aldolase (ALDO) a lyase |
D-glyceraldehyde 3-phosphate (GADP) | dihydroxyacetone phosphate (DHAP) | ||
 |
 |
+ |  |
||
 |
|||||
Cepat Triosephosphate isomerase fosfat
dengan interconverts dihydroxyacetone gliseraldehida 3-fosfat (GADP)
yang keluar lebih jauh ke dalam glikolisis. Hal ini menguntungkan,
karena mengarahkan dihydroxyacetone fosfat ke jalur yang sama seperti
gliseraldehida 3-fosfat, menyederhanakan peraturan.
| Dihydroxyacetone phosphate (DHAP) | triosephosphate isomerase (TPI) an isomerase |
D-glyceraldehyde 3-phosphate (GADP) | |
 |
 |
||
 |
|||
Pay-off fase
Paruh kedua glikolisis dikenal sebagai fase off bayar, ditandai
dengan keuntungan bersih dari molekul yang kaya energi ATP dan NADH.
Sejak glukosa mengarah pada dua triose gula dalam tahap persiapan,
masing-masing reaksi dalam fase membayar-off terjadi dua kali per
glukosa molekul. Ini menghasilkan 2 molekul NADH dan 4 ATP molekul,
mengarah ke keuntungan bersih dari 2 molekul NADH dan 2 molekul ATP dari
jalur glikolitik per glukosa.
Para triose gula adalah dehydrogenated dan anorganik fosfat ditambahkan kepada mereka, membentuk 1,3-bisphosphoglycerate.
Hidrogen digunakan untuk mengurangi dua molekul NAD +, pembawa hidrogen, untuk memberikan NADH + H + untuk setiap triose.
| glyceraldehyde 3-phosphate (GADP) | glyceraldehyde phosphate dehydrogenase (GAPDH) an oxidoreductase |
D-1,3-bisphosphoglycerate (1,3BPG) | |
 |
 |
||
| NAD+ + Pi | NADH + H+ | ||
 |
|||
Atom hidrogen keseimbangan dan keseimbangan muatan keduanya
dipertahankan karena fosfat (Pi) kelompok benar-benar ada dalam bentuk
anion fosfat hidrogen (HPO42-) yang berdisosiasi untuk memberikan
kontribusi tambahan ion H + dan memberikan tuduhan -3 bersih pada kedua
belah pihak.
Langkah ini adalah transfer enzim gugus
fosfat dari 1,3-bisphosphoglycerate ke ADP oleh phosphoglycerate kinase,
membentuk ATP dan 3-phosphoglycerate. Pada langkah ini, glikolisis
telah mencapai titik impas: 2 molekul ATP dikonsumsi, dan 2 molekul baru
kini telah disintesis. Langkah ini, salah satu dari dua tingkat
fosforilasi substrat-langkah, memerlukan ADP; demikian, ketika sel telah
banyak ATP (dan sedikit ADP), reaksi ini tidak terjadi. ATP meluruh
karena relatif cepat jika tidak dimetabolisme, ini peraturan penting
titik di jalur glikolitik.
| 1,3-bisphosphoglycerate (1,3-BPG) | phosphoglycerate kinase (PGK) a transferase |
3-phosphoglycerate (3-P-G) | |
 |
 |
||
| ADP | ATP | ||
 |
|||
| phosphoglycerate kinase (PGK) | |||
ADP benar-benar ada sebagai ADPMg-dan ATP sebagai ATPMg2-, menyeimbangkan -5 pungutan di kedua belah pihak.
Kofaktor: Mg2 +
Mutase sekarang Phosphoglycerate bentuk 2-phosphoglycerate.
| 3-phosphoglycerate (3PG) | phosphoglycerate mutase (PGM) a mutase |
2-phosphoglycerate (2PG) | |
 |
 |
||
Enolase berikutnya phosphoenolpyruvate bentuk dari 2-phosphoglycerate.
Kofaktor: 2 Mg2 +: satu “konformasi” ion untuk berkoordinasi dengan
kelompok karboksilat substrat, dan satu “katalis” ion yang
berpartisipasi dalam dehidrasi.
| 2-phosphoglycerate (2PG) | enolase (ENO) a lyase |
phosphoenolpyruvate (PEP) | |
 |
 |
||
| H2O | |||
 |
|||
| enolase (ENO) | |||
Sebuah akhir fosforilasi tingkat
substrat sekarang membentuk molekul molekul piruvat dan ATP melalui
enzim piruvat kinase. Ini berfungsi sebagai peraturan tambahan langkah,
mirip dengan langkah kinase phosphoglycerate.
Kofaktor: Mg2 +
| phosphoenolpyruvate (PEP) | pyruvate kinase (PK) a transferase |
pyruvate (Pyr) | |
 |
 |
||
| ADP + H+ | ATP | ||
 |
|||
Regulasi
Glikolisis diatur dengan memperlambat
atau mempercepat langkah-langkah tertentu dalam jalur glikolisis. Hal
ini dicapai dengan menghambat atau mengaktifkan enzim yang terlibat.
Langkah-langkah yang diatur dapat ditentukan dengan menghitung perubahan
energi bebas, ΔG, untuk setiap langkah. Jika langkah produk dan reaktan
dalam kesetimbangan, maka langkah diasumsikan tidak dapat diatur.
Karena perubahan energi bebas adalah nol untuk sistem pada
kesetimbangan, setiap langkah dengan perubahan energi bebas mendekati
nol tidak sedang diatur. Jika langkah yang sedang diatur, maka langkah
itu tidak menghasilkan konversi Enzim adalah reaktan menjadi produk
secepat itu bisa, mengakibatkan tumpukan reaktan, yang akan
dikonversikan ke produk jika enzim beroperasi lebih cepat. Karena reaksi
ini thermodynamically menguntungkan, perubahan energi bebas untuk
langkah akan negatif. Sebuah langkah dengan perubahan negatif besar
energi bebas diasumsikan diatur.
Perubahan energi bebas
Perubahan energi bebas, ΔG, untuk setiap
langkah dalam jalur glikolisis dapat dihitung menggunakan ΔG = ΔG ° ‘+
RTln Q, di mana Q adalah reaksi hasil bagi. Ini membutuhkan pengetahuan
yang konsentrasi metabolit. Semua nilai-nilai ini tersedia untuk
eritrosit, dengan pengecualian konsentrasi NAD + dan NADH. Rasio NAD +
menjadi NADH adalah sekitar 1, yang mengakibatkan konsentrasi ini
membatalkan dalam reaksi hasil bagi. (Sejak NAD + dan NADH terjadi pada
sisi berlawanan reaksi, satu akan di pembilang dan yang lain dalam
penyebut.)
Menggunakan konsentrasi diukur setiap langkah, dan standar perubahan
energi bebas, yang sebenarnya perubahan energi bebas dapat dihitung.
| Compound | Concentration / mM |
|---|---|
| glucose | 5.0 |
| glucose-6-phosphate | 0.083 |
| fructose-6-phosphate | 0.014 |
| fructose-1,6-bisphosphate | 0.031 |
| dihydroxyacetone phosphate | 0.14 |
| glyceraldehyde-3-phosphate | 0.019 |
| 1,3-bisphosphoglycerate | 0.001 |
| 2,3-bisphosphoglycerate | 4.0 |
| 3-phosphoglycerate | 0.12 |
| 2-phosphoglycerate | 0.03 |
| phosphoenolpyruvate | 0.023 |
| pyruvate | 0.051 |
| ATP | 1.85 |
| ADP | 0.14 |
| Pi | 1.0 |

The change in free energy for each step of glycolysis estimated from the concentration of metabolites in a erythrocyte.
|
|
| Step | Reaction | ΔG°’ / (kJ/mol) | ΔG / (kJ/mol) |
|---|---|---|---|
| 1 | glucose + ATP4- → glucose-6-phosphate2- + ADP3- + H+ | -16.7 | -34 |
| 2 | glucose-6-phosphate2- → fructose-6-phosphate2- | 1.67 | -2.9 |
| 3 | fructose-6-phosphate2- + ATP4- → fructose-1,6-bisphosphate4- + ADP3- + H+ | -14.2 | -19 |
| 4 | fructose-1,6-bisphosphate4- → dihydroxyacetone phosphate2- + glyceraldehyde-3-phosphate2- | 23.9 | -0.23 |
| 5 | dihydroxyacetone phosphate2- → glyceraldehyde-3-phosphate2- | 7.56 | 2.4 |
| 6 | glyceraldehyde-3-phosphate2- + Pi2- + NAD+ → 1,3-bisphosphoglycerate4- + NADH + H+ | 6.30 | -1.29 |
| 7 | 1,3-bisphosphoglycerate4- + ADP3- → 3-phosphoglycerate3- + ATP4- | -18.9 | 0.09 |
| 8 | 3-phosphoglycerate3- → 2-phosphoglycerate3- | 4.4 | 0.83 |
| 9 | 2-phosphoglycerate3- → phosphoenolpyruvate3- + H2O | 1.8 | 1.1 |
| 10 | phosphoenolpyruvate3- + ADP3- + H+ → pyruvate- + ATP4- | -31.7 | -23.0 |
Dari mengukur konsentrasi metabolit
fisiologis dalam eritrosit tampak bahwa sekitar tujuh langkah dalam
glikolisis berada dalam kesetimbangan untuk tipe sel. Tiga dari
langkah-langkah-yang dengan besar perubahan energi bebas negatif-tidak
berada dalam kesetimbangan dan disebut sebagai ireversibel;
langkah-langkah seperti itu sering tunduk pada peraturan.
Langkah 5 pada gambar akan ditampilkan di belakang langkah-langkah
lain, karena langkah itu merupakan reaksi samping yang dapat menurunkan
atau meningkatkan konsentrasi menengah, gliseraldehida-3-fosfat. Senyawa
yang dikonversikan ke dihydroxyacetone fosfat oleh enzim, triose fosfat
isomerase, yang merupakan enzim catalytically sempurna; laju begitu
cepat sehingga reaksi dapat diasumsikan dalam kesetimbangan. Fakta bahwa
ΔG tidak nol menunjukkan bahwa konsentrasi yang sebenarnya dalam
eritrosit tidak akurat diketahui.
Biokimia logika
dia adanya lebih dari satu titik
peraturan menunjukkan bahwa peralihan antara titik-titik masuk dan
keluar jalur glikolisis oleh proses lain. Sebagai contoh, dalam langkah
diatur pertama, heksokinase mengkonversi glukosa menjadi
glukosa-6-fosfat. Daripada terus melalui jalur glikolisis, perantara ini
dapat diubah menjadi molekul glukosa penyimpanan, seperti glikogen atau
pati. Reaksi sebaliknya, meruntuhkan, misalnya, glikogen, terutama
menghasilkan glukosa-6-fosfat; sangat sedikit glukosa bebas terbentuk
dalam reaksi. Glukosa-6-fosfat yang dihasilkan dapat memasukkan
glikolisis setelah titik kontrol pertama.
Diatur kedua langkah (langkah ketiga glikolisis) fosfofruktokinase
mengkonversi fruktosa-6-fosfat menjadi fruktosa-1 ,6-bisphosphate, yang
kemudian diubah menjadi gliseraldehida-3-fosfat dan dihydroxyacetone
fosfat. Dihydroxyacetone fosfat yang dapat dihilangkan dari glikolisis
oleh konversi menjadi gliserol-3-fosfat, yang dapat digunakan untuk
membentuk trigliserida. Sebaliknya, trigliserida dapat dibagi menjadi
asam lemak dan gliserol; yang terakhir, pada gilirannya, dapat
dikonversi ke dihydroxyacetone fosfat, yang dapat masuk glikolisis
setelah titik kontrol kedua.
Regulasi
Ketiga enzim diatur heksokinase, fosfofruktokinase, dan piruvat kinase.
Fluks melalui jalur glikolitik disesuaikan dalam menanggapi kondisi
baik di dalam maupun di luar sel. Laju di hati diatur untuk memenuhi
kebutuhan selular utama: (1) produksi ATP, (2) penyediaan biosintetik
blok bangunan untuk reaksi, dan (3) untuk menurunkan glukosa darah,
salah satu fungsi utama hati. Ketika gula darah turun, glikolisis
dihentikan di hati untuk memungkinkan proses kebalikannya,
glukoneogenesis. Dalam glikolisis, reaksi dikatalisis oleh heksokinase,
fosfofruktokinase, dan piruvat kinase secara efektif ireversibel pada
kebanyakan organisme. Dalam jalur metabolisme, seperti situs berpotensi
enzim kontrol, dan ketiganya enzim melayani tujuan ini dalam glikolisis.
Hexokinase
Pada hewan, peraturan kadar glukosa darah
oleh hati adalah bagian vital dari homeostasis. Dalam sel hati, ekstra
G6P (glukosa-6-fosfat) dapat dikonversi menjadi G1P untuk konversi
glikogen, atau itu alternatif dikonversi oleh glikolisis menjadi
asetil-KoA dan kemudian sitrat. Kelebihan citrate diekspor ke sitosol,
dimana ATP sitrat lyase akan diperbarui asetil-KoA dan OAA. Asetil-KoA
yang kemudian digunakan untuk sintesis asam lemak dan kolesterol
sintesis, dua cara penting pemanfaatan kelebihan glukosa bila
konsentrasi yang tinggi dalam darah. Hati mengandung heksokinase dan
glukokinase; catalyses yang terakhir fosforilasi glukosa untuk G6P dan
tidak dihambat oleh G6P. Jadi memungkinkan glukosa untuk dikonversi
menjadi glikogen, asam lemak, dan kolesterol bahkan ketika kegiatan
heksokinase rendah. Hal ini penting ketika kadar glukosa darah tinggi.
Selama hipoglikemia, yang glikogen dapat diubah kembali ke G6P dan
kemudian dikonversi menjadi glukosa oleh enzim spesifik hati-glukosa
6-fosfatase. Reaksi balik ini adalah peran penting sel hati untuk
menjaga tingkat gula darah selama puasa. Ini penting untuk fungsi otak,
karena otak menggunakan glukosa sebagai sumber energi dalam sebagian
besar kondisi.
Phosphofructokinase
Fosfofruktokinase adalah titik kontrol
penting dalam jalur glikolitik, karena merupakan salah satu langkah
ireversibel dan memiliki alosterik kunci efektor, AMP dan fruktosa
2,6-bisphosphate (F2, 6BP).
Fruktosa 2,6-bisphosphate (F2, 6BP) adalah penggerak yang sangat
ampuh fosfofruktokinase (PFK-1) yang disintesis ketika F6P difosforilasi
oleh fosfofruktokinase kedua (PFK2). Dalam hati, ketika gula darah
rendah dan glukagon mengangkat cAMP, PFK2 difosforilasi oleh protein
kinase A. inactivates PFK2 fosforilasi, dan domain lain protein ini akan
menjadi aktif sebagai fruktosa 2,6-bisphosphatase, yang mengubah F2,
6BP kembali ke F6P . Baik glukagon dan epinefrin menyebabkan tingginya
kadar cAMP dalam hati. Hasil dari tingkat yang lebih rendah hati
fruktosa-2 ,6-bisphosphate penurunan dalam kegiatan fosfofruktokinase
dan peningkatan kegiatan fruktosa 1,6-bisphosphatase, sehingga
glukoneogenesis (dasarnya “glikolisis secara terbalik”) lebih disukai.
Hal ini konsisten dengan peranan hati dalam situasi seperti itu, karena
tanggapan dari hati hormon ini adalah untuk melepaskan glukosa ke dalam
darah.

ATP bersaing dengan AMP untuk efektor alosterik situs di PFK enzim. Konsentrasi ATP di dalam sel lebih tinggi daripada AMP, biasanya 100-kali lipat lebih tinggi, tetapi konsentrasi ATP tidak berubah lebih dari sekitar 10% di bawah kondisi fisiologis, sedangkan 10% penurunan hasil ATP dalam sebuah 6-kali lipat di AMP. Dengan demikian, relevansi ATP sebagai efektor alosterik dipertanyakan. Peningkatan AMP adalah sebuah konsekuensi dari penurunan biaya energi dalam sel.

ATP bersaing dengan AMP untuk efektor alosterik situs di PFK enzim. Konsentrasi ATP di dalam sel lebih tinggi daripada AMP, biasanya 100-kali lipat lebih tinggi, tetapi konsentrasi ATP tidak berubah lebih dari sekitar 10% di bawah kondisi fisiologis, sedangkan 10% penurunan hasil ATP dalam sebuah 6-kali lipat di AMP. Dengan demikian, relevansi ATP sebagai efektor alosterik dipertanyakan. Peningkatan AMP adalah sebuah konsekuensi dari penurunan biaya energi dalam sel.
Citrate menghambat fosfofruktokinase saat diuji in vitro dengan
meningkatkan efek penghambatan ATP. Namun, diragukan bahwa ini adalah
efek yang berarti in vivo, karena dalam sitosol sitrat terutama
dimanfaatkan untuk konversi menjadi asetil-KoA untuk asam lemak dan
kolesterol sintesis.
Pyruvate kinase
Enzim ini mengkatalisis langkah terakhir glikolisis, di mana piruvat
dan ATP terbentuk. Peraturan enzim ini dibahas dalam topik utama,
piruvat kinase.
Post-proses glikolisis
Proses keseluruhan glikolisis adalah:
glukosa + 2 NAD + + 2 ADP + 2 Pi → 2 piruvat + 2 NADH + 2 H + + 2 ATP + 2 H2O
Jika glikolisis adalah untuk terus tanpa batas waktu, seluruh NAD +
akan digunakan, dan glikolisis akan berhenti. Untuk memungkinkan
glikolisis untuk melanjutkan, organisme harus dapat mengoksidasi NADH
kembali ke NAD +.
Respirasi anaerobik
Salah satu metode untuk melakukan ini adalah dengan hanya memiliki
piruvat melakukan oksidasi; dalam proses ini, piruvat diubah menjadi
laktat (basa konjugat asam laktat) dalam proses yang disebut fermentasi
asam laktat:
piruvat + NADH + H + → laktat + NAD +
Proses ini terjadi pada bakteri yang terlibat dalam pembuatan yogurt
(asam laktat menyebabkan susu menjadi dadih). Proses ini juga terjadi
pada hewan di bawah hipoksia (atau sebagian-anaerobik) kondisi,
ditemukan, misalnya, dalam terlalu banyak bekerja otot yang kekurangan
oksigen, atau di infarcted sel-sel otot jantung. Dalam banyak jaringan,
ini adalah terakhir selular untuk energi; sebagian besar jaringan hewan
tidak dapat mempertahankan respirasi anaerobik untuk jangka waktu
panjang.
Beberapa organisme, seperti ragi, mengkonversi NADH kembali ke NAD +
dalam proses yang disebut fermentasi etanol. Dalam proses ini, pertama
piruvat dikonversikan menjadi asetaldehida dan karbon dioksida, kemudian
ke etanol.
Asam laktat fermentasi dan etanol fermentasi dapat terjadi tanpa
adanya oksigen. Fermentasi anaerobik ini memungkinkan banyak organisme
bersel tunggal menggunakan glikolisis sebagai satu-satunya sumber
energi.
Dalam dua contoh di atas fermentasi, NADH dioksidasi dengan
mentransfer dua elektron untuk piruvat. Namun, bakteri anaerob
menggunakan berbagai senyawa sebagai akseptor elektron terminal pada
respirasi sel: senyawa nitrogen, seperti nitrat dan nitrit; senyawa
belerang, seperti sulfat, sulfida, sulfur dioksida, dan unsur belerang;
karbon dioksida; senyawa besi; senyawa mangan; kobalt senyawa dan
senyawa uranium.
Respirasi aerobik
Dalam organisme aerobik, mekanisme yang rumit telah berevolusi untuk
menggunakan oksigen di udara sebagai akseptor elektron terakhir dari
respirasi.
* Pertama, piruvat diubah menjadi asetil-KoA dan CO2 dalam mitokondria dalam proses yang disebut piruvat dekarboksilasi.
* Kedua, asetil-CoA memasuki siklus asam sitrat, di mana sepenuhnya teroksidasi menjadi karbon dioksida dan air, menghasilkan lebih banyak NADH.
* Ketiga, NADH dioksidasi untuk NAD + oleh rantai transpor elektron, dengan menggunakan oksigen sebagai akseptor elektron terakhir. Proses ini menciptakan sebuah “gradien ion hidrogen” melintasi membran dalam mitokondria.
* Keempat, gradien proton yang digunakan untuk menghasilkan sejumlah besar ATP dalam proses yang disebut oksidatif fosforilasi.
* Kedua, asetil-CoA memasuki siklus asam sitrat, di mana sepenuhnya teroksidasi menjadi karbon dioksida dan air, menghasilkan lebih banyak NADH.
* Ketiga, NADH dioksidasi untuk NAD + oleh rantai transpor elektron, dengan menggunakan oksigen sebagai akseptor elektron terakhir. Proses ini menciptakan sebuah “gradien ion hidrogen” melintasi membran dalam mitokondria.
* Keempat, gradien proton yang digunakan untuk menghasilkan sejumlah besar ATP dalam proses yang disebut oksidatif fosforilasi.
Zat antara jalur-jalur lain
Artikel ini memusatkan perhatian pada peran katabolik glikolisis
berkenaan dengan potensi mengubah energi kimia ke energi kimia yang
dapat digunakan selama oksidasi glukosa untuk piruvat. Namun, banyak
dari metabolit di jalur glikolitik juga digunakan oleh jalur anabolik,
dan, sebagai akibatnya, fluks melalui jalur sangat penting untuk
mempertahankan persediaan karbon kerangka untuk biosintesis.
Selain itu, tidak semua karbon memasuki jalur daun piruvat dan dapat
diambil pada tahap-tahap awal untuk menyediakan senyawa karbon
jalur-jalur lainnya.
Jalur metabolik ini semua sangat bergantung pada glikolisis sebagai sumber metabolit:
* Glukoneogenesis
* Lipid metabolisme
* Pentosa jalur fosfat
* Siklus asam sitrat, yang pada gilirannya mengarah pada:
* Lipid metabolisme
* Pentosa jalur fosfat
* Siklus asam sitrat, yang pada gilirannya mengarah pada:
* Sintesis asam amino
* Nukleotida sintesis
* Tetrapyrrole sintesis
* Nukleotida sintesis
* Tetrapyrrole sintesis
Dari sudut pandang metabolisme anabolik, yang NADH memiliki peran
untuk mendorong reaksi sintetis, melakukannya secara langsung atau tidak
langsung mengurangi genangan NADP + dalam sel untuk NADPH, yang
merupakan agen pereduksi penting lainnya untuk biosintetik dalam sel.
Glikolisis dalam penyakit
Penyakit genetika
Glikolitik mutasi umumnya jarang karena pentingnya jalur metabolisme,
ini berarti bahwa sebagian besar hasil mutasi yang terjadi dalam
ketidakmampuan untuk sel untuk bernafas, dan karena itu menyebabkan
kematian sel pada tahap awal. Namun beberapa mutasi terlihat.
Kanker
Ganas yang tumbuh dengan cepat-sel tumor biasanya memiliki tingkat glikolitik yang hingga 200 kali lebih tinggi daripada jaringan normal mereka asal. Fenomena ini pertama kali dijelaskan pada 1930 oleh Otto Warburg dan disebut sebagai efek Warburg. Hipotesis yang Warburg menyatakan bahwa kanker ini terutama disebabkan oleh mitokondria dysfunctionality dalam metabolisme, bukan karena pertumbuhan sel yang tidak terkendali. Sejumlah teori telah dikemukakan untuk menjelaskan efek Warburg.
Ganas yang tumbuh dengan cepat-sel tumor biasanya memiliki tingkat glikolitik yang hingga 200 kali lebih tinggi daripada jaringan normal mereka asal. Fenomena ini pertama kali dijelaskan pada 1930 oleh Otto Warburg dan disebut sebagai efek Warburg. Hipotesis yang Warburg menyatakan bahwa kanker ini terutama disebabkan oleh mitokondria dysfunctionality dalam metabolisme, bukan karena pertumbuhan sel yang tidak terkendali. Sejumlah teori telah dikemukakan untuk menjelaskan efek Warburg.
Tingkat glikolisis tinggi ini memiliki aplikasi medis penting,
seperti glikolisis aerobik tinggi oleh tumor ganas dimanfaatkan secara
klinis untuk mendiagnosa dan memantau tanggapan pengobatan kanker dengan
pencitraan pengambilan 2-18F-2-deoxyglucose (FDG) (a radioaktif diubah
heksokinase substrat) dengan positron emisi tomografi (PET).
Ada penelitian berkelanjutan untuk mempengaruhi metabolisme
mitokondria dan mengobati kanker dengan mengurangi kelaparan dan dengan
demikian glikolisis sel-sel kanker dalam berbagai cara baru, termasuk
ketogenic diet.
penyakit Alzheimer
Disfunctioning glikolisis atau metabolisme glukosa dalam fronto-temporo-Cinguli korteks parietalis dan telah dikaitkan dengan penyakit Alzheimer , mungkin karena penurunan amiloid β (1-42) (Aβ42) dan peningkatan tau, terfosforilasi tau di cairan cerebrospinal (CSF ).
Disfunctioning glikolisis atau metabolisme glukosa dalam fronto-temporo-Cinguli korteks parietalis dan telah dikaitkan dengan penyakit Alzheimer , mungkin karena penurunan amiloid β (1-42) (Aβ42) dan peningkatan tau, terfosforilasi tau di cairan cerebrospinal (CSF ).
Alternatif tatanama
Beberapa metabolit dalam glikolisis memiliki nama dan tata-nama
alternatif. Sebagian, hal ini karena beberapa dari mereka yang umum
jalur-jalur lainnya, seperti siklus Calvin.
| This article | Alternative names | Alternative nomenclature | ||
|---|---|---|---|---|
| 1 | glucose | Glc | dextrose | |
| 3 | fructose 6-phosphate | F6P | ||
| 4 | fructose 1,6-bisphosphate | F1,6BP | fructose 1,6-diphosphate | FBP, FDP, F1,6DP |
| 5 | dihydroxyacetone phosphate | DHAP | glycerone phosphate | |
| 6 | glyceraldehyde 3-phosphate | GADP | 3-phosphoglyceraldehyde | PGAL, G3P, GALP,GAP,TP |
| 7 | 1,3-bisphosphoglycerate | 1,3BPG | glycerate 1,3-bisphosphate, glycerate 1,3-diphosphate, 1,3-diphosphoglycerate |
PGAP, BPG, DPG |
| 8 | 3-phosphoglycerate | 3PG | glycerate 3-phosphate | PGA, GP |
| 9 | 2-phosphoglycerate | 2PG | glycerate 2-phosphate | |
| 10 | phosphoenolpyruvate | PEP | ||
| 11 | pyruvate | Pyr | pyruvic acid | |
Referensi :
- ^ Webster’s New International Dictionary of the English Language, 2nd ed. (1937) Merriam Company, Springfield, Mass.
- ^ Romano AH, Conway T. (1996) Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448-55 PMID 9084754
- ^ a b Lane, A. N.; Fan, T. W. -M.; Higashi, R. M. (2009). “Metabolic acidosis and the importance of balanced equations”. Metabolomics 5: 163–165. doi:10.1007/s11306-008-0142-2. edit
- ^ Reeves, R. E.; South D. J., Blytt H. J. and Warren L. G. (1974). “Pyrophosphate: D-fructose 6-phosphate 1-phosphotransferase. A new enzyme with the glycolytic function 6-phosphate 1-phosphotransferase”. J Biol Chem 249 (24): 7737–7741. PMID 4372217.
- ^ Selig, M.; Xavier K. B., Santos H. and Schönheit P. (1997). “Comparative analysis of Embden-Meyerhof and Entner-Doudoroff glycolytic pathways in hyperthermophilic archaea and the bacterium Thermotoga“. Arch Microbiol 167 (4): 217–232. PMID 9075622.
- ^ Garrett, R.; Grisham, C. M. (2005). Biochemistry (3rd ed.). Belmont, CA: Thomson Brooks/Cole. p. 584. ISBN 0-534-49011-6.




No comments:
Post a Comment